 更多“已知298K下计算.”相关的问题
更多“已知298K下计算.”相关的问题
第2题
298K时,已知,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg卐
298K时,已知,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg卐
点击查看答案
298K时,已知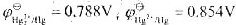 ,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg2+→Hg2-设计电池,并计算该反应的标准平衡常数。
,试计算(1)反应Hg2++e→1/2Hg22+的标准电极电势。(2)为反应Hg+Hg2+→Hg2-设计电池,并计算该反应的标准平衡常数。
第3题
已知,请计算反应2Cu+=Cu2++Cu在298K时的反应平衡常数.并由此说明+1价简单Cu+
已知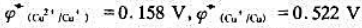 ,请计算反应2Cu+=Cu2++Cu在298K时的反应平衡常数.并由此说明+1价简单Cu+阳离子能否稳定存在于水溶液中?
,请计算反应2Cu+=Cu2++Cu在298K时的反应平衡常数.并由此说明+1价简单Cu+阳离子能否稳定存在于水溶液中?
第4题
已知反应2Cr3++3Cl2+7H2O=Cr2O72-+6C1-+14H+(Cr2⌘
已知反应2Cr3++3Cl2+7H2O=Cr2O72-+6C1-+14H+(Cr2⌘
点击查看答案
已知反应
2Cr3++3Cl2+7H2O=Cr2O72-+6C1-+14H+
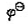 (Cr2O72-/Cr3+)=1.33V,
(Cr2O72-/Cr3+)=1.33V,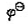 (Cl2/CI-)=1.36V,F=95500J·V-1·mol-2若在298K时组成原电池。
(Cl2/CI-)=1.36V,F=95500J·V-1·mol-2若在298K时组成原电池。
(1)写出该原电监的电池符号,并计算标准电动势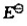 ;(2)计算
;(2)计算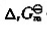 (298K)并判断反应进行的方向;(3)计算标准平衡常数
(298K)并判断反应进行的方向;(3)计算标准平衡常数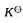 ;(4)若c(H+)=10mol·dm-3,其他离子浓度均为标准浓度,求原电池的电动势E并判断反应进行的方向
;(4)若c(H+)=10mol·dm-3,其他离子浓度均为标准浓度,求原电池的电动势E并判断反应进行的方向
第5题
298K时,将某可逆电池短路使其放电Imol电子的电量,此时放电的热量恰好等于该电池可逆操作时所
吸收热量的40倍.试计算此电池的电动势。已知此电池电动势的温度系数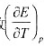
点击查看答案
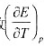
为1.40x10-4V/K。
第6题
在298K. 101.325kPa下,lmol过冷水然气变为298K. 101.325kPa的液态水,求此过程的ΔS及ΔG。已知298K水的饱和然气压为3.1674kPa.气化热为2217kJ/kg。上述过程能否自发进行?
第7题
植物在光合作用中合成葡萄糖的反应可以近似表示为:6CO2(g)+6H2O(1)=C6H12O
植物在光合作用中合成葡萄糖的反应可以近似表示为:
6CO2(g)+6H2O(1)=C6H12O6(s)+6O2(g)
计算反应的标准摩尔吉布斯自由能,判断反应在298K及标准状态下能否自发进行,已知葡萄糖的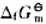 (C6H12O6·s) =-910.5kJ·mol-1。
(C6H12O6·s) =-910.5kJ·mol-1。
第8题
根据附表六中能查到的相关电对的标准电极电势的数据,判断下列物种能否歧化确定其最稳定的产物,并写出歧化反应的离子方程式,计算298K下反应的标准平衡常数.(1)In+(aq);(2)TI+(aq);(3)Br2(l)在碱性溶液中.
根据附表六中能查到的相关电对的标准电极电势的数据,判断下列物种能否歧化确定其最稳定的产物,并写出歧化反应的离子方程式,计算298K下反应的标准平衡常数.(1)In+(aq);(2)TI+(aq);(3)Br2(l)在碱性溶液中.
点击查看答案
第9题
已知下述反应298K时的热效应:求C6H5COOH(1)的标准生成热ΔHƟm。
已知下述反应298K时的热效应:求C6H5COOH(1)的标准生成热ΔHƟm。
点击查看答案
已知下述反应298K时的热效应:
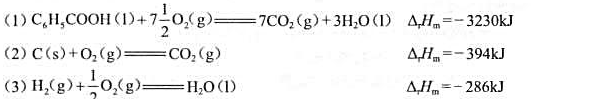 求C6H5COOH(1)的标准生成热ΔHƟm。
求C6H5COOH(1)的标准生成热ΔHƟm。
第10题
已知反应2NO(g)+Br2(g)=2NOBr(g)是放热反应,298K时K=116。判断下列各种状态反应自发进行的
已知反应2NO(g)+Br2(g)=2NOBr(g)是放热反应,298K时K=116。判断下列各种状态反应自发进行的
点击查看答案
方向。
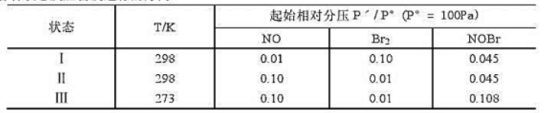

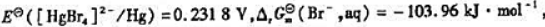 计算
计算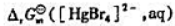 .
.
 如果结果不匹配,请
如果结果不匹配,请 
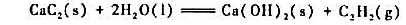
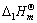 。
。
















