 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
由“反应”所得溶液中尽可能多地析出Cu(NO3)2.3H2O晶体的方法是()。(相关物质的溶解度曲线如图所示)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“由“反应”所得溶液中尽可能多地析出Cu(NO3)2.3H2O…”相关的问题
更多“由“反应”所得溶液中尽可能多地析出Cu(NO3)2.3H2O…”相关的问题
A.Mn、Cu、Ni 、H
B.H、Ni、Mn、Cu
C.Mn、Ni、H、Cu
D.u、H、Ni、Mn
A.蓝色沉淀溶解的离子方程式为Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
B.NH3极易溶于水是因为氨分子间易形成氢键
C.硫酸四氨合铜在乙醇中的溶解度小于在水中的溶解度
D.NH3比H2O更容易与Cu2+反应形成配合物
A.X、Y、Z的金属活动性依次减弱
B.X金属可能是铜(Cu)
C.Z金属一定是金(Au)
D.Y与硝酸银的反应属于复分解反应
超细纳米铜粉的比表面积大、表面活性中心数目多,在冶金和石油化工中是优良的催化剂。利用铜屑制备超细纳米铜粉的工艺流程如下: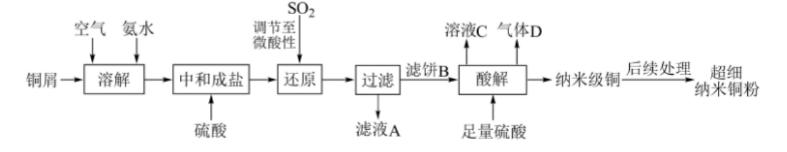 回答下列问题:
回答下列问题:
(1)“溶解”的离子方程式为(),为了加快“溶解”反应,可采取的措施有()(写出一种即可)。
(2)“滤饼B”是一种白色晶体,元素分析表明含有Cu、S、O、N、H五种元素,Cu、S、N的原子数目比为1:1:1,光谱分析显示所含阴离子呈三角锥形,其中一种阳离子呈正四面体形,则该晶体的化学式为()。
(3)“酸解”的化学方程式为();验证酸解后所得铜粉为纳米级的简便方法是()(填操作及现象)。
(4)“溶液C”可以循环利用,应将其导入到()操作中(填操作单元的名称)。
A.牛油与NaOH溶液共煮,向反应后所得液体中加入食盐,会有固体析出
B.一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞
C.向FeCl3溶液中加入Na2CO3溶液,会出现红褐色沉淀
D.在河水与海水的交界处,有三角洲形成
电解工作原理的实际应用非常广泛。
(1)请画出铜棒镀银的简易装置设计图()。(实验可选用品:铜棒,银片,石墨棒,硫酸铜溶液,硝酸银溶液,导线,电源,烧杯)。
(2)工业上为了处理含有Cr2O12-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是()(填字母)。
A、阳极反应:Fe-2e-=Fe2+
B、阴极反应:2H++2e-=H2↑
C、在电解过程中工业废水由酸性变为碱性
D、可以将铁电极改为石墨电极
(3)某同学设计了如图装置进行以下电化学实验。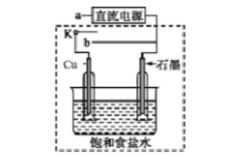 ①当开关K与a连接时,两极均有气泡产生,则阴极为()电极。
①当开关K与a连接时,两极均有气泡产生,则阴极为()电极。
②一段时间后,使开关K与a断开,与b连接时,虚线框内的装置可称为()。请写出此时Cu电极上的电极反应()。
(4)某溶液中含有的离子如下表: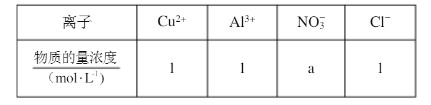 用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积变化及电极产物可能存在的溶解现象),下列说法正确的是()(填字母)。
用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积变化及电极产物可能存在的溶解现象),下列说法正确的是()(填字母)。
A、电解后溶液呈酸性
B、a=3
C、阳极生成1.5molCl2
D、阴极析出的金属是铜与铝
A.Mg>X>Cu
B.X>Mg>Cu
C.Mg>Cu>X
D.u>Mg>X
如图是探究金属化学性质的四个实验,有关叙述不正确的是()。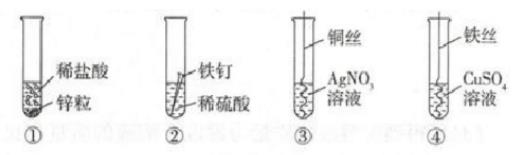
A.
由①和②可以得出金属活动性: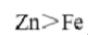
B.
由③和④可以得出金属活动性: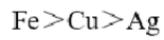
C.
③中铜丝表面有银白色物质析出,溶液变成蓝色
D.
②中反应的化学方程式为: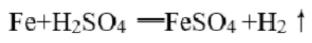
A.33.7%
B.33.74%
C.67.49%
D.67.5%
A.丙、甲、乙
B.甲、乙、丙
C.乙、甲、丙
D.甲、丙、乙
绿色固体(C)的原料。高温下,(C)与气体(D)反应生成气体(E),常温下(E)为白色晶体。(E)在氢氧化钠溶液中强烈水解,析出黄色固体(F),其加热脱水所得无水盐称为铀黄,高温下,用还原性气体(G)还原固体(H)和(I)均可得到固体(B)。固体(H)可溶于硝酸,该溶液经蒸发、冷却、结晶可得亮黄色晶体(J),若向(J)的溶液中滴加氨水可得亮黄色沉淀(K)。将(J)和(K)高温煅烧又可分别得到固体(H)。固体(H)还可与氢氧化钠反应,析出固体(F)。高温下,固体(H)可转化为固体(I),并放出能使带火星木条复燃的气体(L)。气体(D)是一种强氧化剂,其水解产生弱酸(M)和气体(L)。试给出(A),(B),(C),(D),(E),(F),(G),(H),(I),(J),(K),(L)和(M)所代表的物质的化学式,并写出有关化学反应方程式。