 更多“铜锌稀硫酸原电池工作时,SO42-离子向哪一极移动()”相关的问题
更多“铜锌稀硫酸原电池工作时,SO42-离子向哪一极移动()”相关的问题
解释以下事实:
(1)单质铁与盐酸作用的产物是FeCl2,但在与氯气反应时的产物是FeCl3.
(2)单质银没有氢活泼,但Ag可从Hl溶液中置换出氢气.
(3)硝酸钠或稀硫酸溶液都没有明显的氧化性,例如,它们都不可能氧化Fe2+为Fe3+,但二者结合后都可以使Fe2+氧化为Fe3+.
(4)久置于空气的H2S溶液会变浑浊.
(5)Fel3,Cul2等化合物不存在.
(6)在碱性溶液条件下,金属铁可得到暂时性保护.
(7)用简单的锌盐及铜盐混合液进行电镀时,锌和铜不会同时析出.但在混合离子溶液中加入NaCN溶液,可使Cu,Zn同时析出.
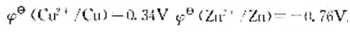 ,求此时原电池的电动势比标准状态时的电动势()
,求此时原电池的电动势比标准状态时的电动势()A.上升0.24V
B.下降0.24V
C.上升0.12V
D.下降0.12V
A.滤出的不溶物一定是铜
B.滤出的不溶物一定是铁
C.滤出的不溶物中一定会有铜,可能含有铁
D.滤液中一定含有硫酸根离子,亚铁离子,可能会有铜离子
以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以此废渣制备铁红(Fe2O3)的过程如下。此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见右表。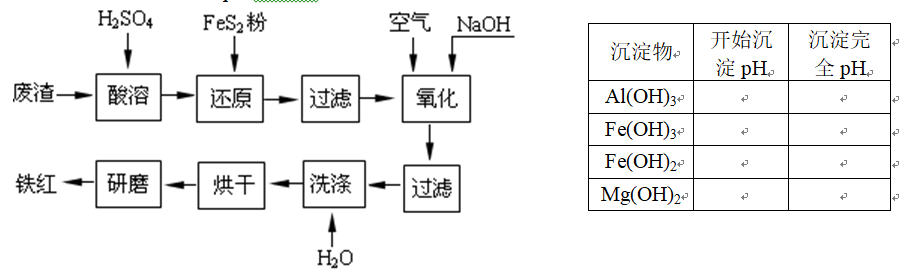 问题一、酸溶过程中Fe2O3与稀硫酸反应的化学方程式是()。
问题一、酸溶过程中Fe2O3与稀硫酸反应的化学方程式是()。
问题二、复原过程中加入FeS2是将溶液中的Fe3+复原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:()。
问题三、氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:()。
问题四、为了确保铁红的质量,氧化过程需要调节溶液pH的范围为()≤pH<()。
问题五、假设NaOH加入过量,所的铁红产品中有其它杂质,但可能无Al2O3,其原因是(用离子方程式表示):() 。
①向溶液中先滴加过量硫酸铁溶液,产生红褐色沉淀;
②继续滴加过量的氯化钡溶液,产生白色沉淀。
下列说法正确的是()。
A.原溶液中一定存在的离子:Na+,SO42-,OH
B.原溶液中一定不存在的离子只有Cu2+
C.原溶液中可能存在的离子:SO42-,NO3-
D.红褐色沉淀的化学式为Fe(OH)2
A.6.1g
B.6.2g
C.6.3g
D.6.5g
A.1:3
B.1:2
C.3:4
D.2:3


 如果结果不匹配,请
如果结果不匹配,请 

















