 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
哪些因素影响元素的原子半径和第一电离能的变化?周期表中同周期、同族元素原子半径和第一电离能呈现怎样的变化趋势?有哪些反常现象?为什么会有这些反常现象?
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“哪些因素影响元素的原子半径和第一电离能的变化?周期表中同周期…”相关的问题
更多“哪些因素影响元素的原子半径和第一电离能的变化?周期表中同周期…”相关的问题
在周期表中,同一主族元素从上到下,非金属性减弱的主要原因是()。
A.核电荷数增加
B.原子半径增大
C.元素电负性增大
D.电离能增大
已知氨原子基态的径向波函数为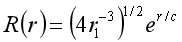 ,式中r1为玻尔第一轨道半径求电子处于玻尔第二轨道半径(r1=4r1)和玻尔第一轨道半径处的概率密度的比值。
,式中r1为玻尔第一轨道半径求电子处于玻尔第二轨道半径(r1=4r1)和玻尔第一轨道半径处的概率密度的比值。
A.原子半径发生周期性变化
B.电负性发生周期性变化
C.核外电子排布发生周期性变化
D.有效核电荷发生周期性变化