 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
100kPa下将1mol的Zn(s)由25℃加热到98℃,测得其摩尔体积由9.16cm3·mol-1变化到9.22cm3·mol-1.过程的ΔH-ΔU=()J.
A.6x10-3;
B.6;
C.6000;
D.0.6
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.6x10-3;
B.6;
C.6000;
D.0.6
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“100kPa下将1mol的Zn(s)由25℃加热到98℃,测…”相关的问题
更多“100kPa下将1mol的Zn(s)由25℃加热到98℃,测…”相关的问题
Hg在100kPa下的熔点为-38.87℃,此时比熔化焓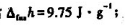 液态Hg和固态Hg的密度分别为ρ(l)=13.690g·cm-3和ρ(s)=14.193g·cm-3.求:
液态Hg和固态Hg的密度分别为ρ(l)=13.690g·cm-3和ρ(s)=14.193g·cm-3.求:
(1)压力为10MPa下Hg的熔点:
(2)若要Hg的熔点为-35C,压力简增大至多少?
(2)从书中查出上述各碳酸盐的分解温度(CdCO3为345℃),与计算结果加以比较,并加以评价.
(3)各碳酸盐分解温度的实验值与由计算结果所得出的有关碳酸盐的分解温度的规律是否一致?并从离子半径、离子电荷、离子的电子构型等因素对上述规律加以说明.
(3)分解温度的实际值和计算值的规律是一致的.金属离子的半径越小,离子所带的电荷数越大,极化能力就越强,相应碳酸盐分解温度越低;金属离子电子构型为18e的极化能力比8e的强;而极化越大,相应的碳酸盐越易分解.
冰(H2O,s)在100kPa下的熔点为0℃,此条件下的摩尔融化焓 =6.012kJ·mol-1.已知在-10~0℃范围内过冷水(H2O,l)和冰的摩尔定压热容分别为76.28J·mol-1·K-1和37.20J·mol-1·
=6.012kJ·mol-1.已知在-10~0℃范围内过冷水(H2O,l)和冰的摩尔定压热容分别为76.28J·mol-1·K-1和37.20J·mol-1·
K-1.求在常压及-10℃下过冷水结冰的摩尔凝固焓.
如图所示,无摩擦、无质量、无体积的活塞1,2,3将反应器隔成甲、乙、丙3部分,分别进行反应
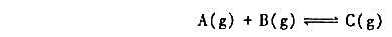
起始时物质的量已标在图中。某温度和100kPa下实现平衡时,各部分的体积分别为V甲,V乙,V丙。
(1)这时若去掉活塞1,不会引起其他活塞移动,求算x值;
(2)去掉活塞2后再次达到平衡时,活塞3向哪个方向发生了移动?试通
过计算加以解释,可以假定反应的Kθ等于1。
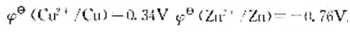 ,求此时原电池的电动势比标准状态时的电动势()
,求此时原电池的电动势比标准状态时的电动势()A.上升0.24V
B.下降0.24V
C.上升0.12V
D.下降0.12V
在一定温度下,将1.0molNa2O2(g)放入一密闭容器中,发生下列可逆反应
 当达到化学平衡时,容器内有0.8molNO,气体总压为100kPa。则该可逆反应在此温度下的标准平衡常数为().
当达到化学平衡时,容器内有0.8molNO,气体总压为100kPa。则该可逆反应在此温度下的标准平衡常数为().
A、0.40
B、0.67
C、0.76
D、1.3