 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
将新鲜的萝卜条放在一定浓度的某溶液中,一段时间后发现萝卜条变软。产生这种现象原因是()
A.细胞内溶液浓度小于外界溶液浓度,细胞失水
B.细胞内溶液浓度小于外界溶液浓度,细胞吸水
C.细胞内溶液浓度大于外界溶液浓度,细胞失水
D.细胞内溶液浓度大于外界溶液浓度,细胞吸水
 答案
答案
A、细胞内溶液浓度小于外界溶液浓度,细胞失水
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.细胞内溶液浓度小于外界溶液浓度,细胞失水
B.细胞内溶液浓度小于外界溶液浓度,细胞吸水
C.细胞内溶液浓度大于外界溶液浓度,细胞失水
D.细胞内溶液浓度大于外界溶液浓度,细胞吸水
 答案
答案
A、细胞内溶液浓度小于外界溶液浓度,细胞失水
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“将新鲜的萝卜条放在一定浓度的某溶液中,一段时间后发现萝卜条变…”相关的问题
更多“将新鲜的萝卜条放在一定浓度的某溶液中,一段时间后发现萝卜条变…”相关的问题
下图是探究某绿色植物光合速率的实验装置图,装置中的NaHCO3溶液可维持瓶内的CO2浓度相对稳定,将该装置放在20①、一定光照条件下实验开始时,针筒的读数是0.2mL。毛细管内的有色液滴在A处30min后,针筒的读数需要调至0.6mL,才能使有色液滴维持在A处下列有关叙述错误的是()。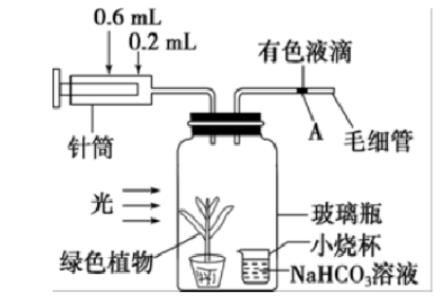
A.该实验过程中光合速率大于呼吸速率
B.若测定植物的实际光合速率,还需要在暗处测定呼吸速率
C.若将小烧杯中的NaHCO3溶液换成清水,则一段时间后光合作用会停止
D.若用该装置探究该植物生长的最适温度,NaHCO3溶液浓度和光照强度等都是无关变量
A.在碳酸钠溶液中滴加酚酞试液变红色可证明碳酸钠属于碱类
B.将燃着的木条伸入某无色气体中,木条B灭,该气体不一定是二氧化碳
C.把某物质在氧气中完全燃烧,生成了氧化物,可证明该物质一定是单质
D.将浓盐酸置于空气中浓度会减小,可证明浓盐酸具有吸水性
随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行别离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5mol•L-1时通常认为该离子沉淀完全)。 问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。
问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。
问题二、为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准
①Cr2O72-转变为Cr3+的离子方程式为()。
②pH对废水中Cr2072-去除率的影响如右图。你认为电解过程中溶液的pH取值在()范围内对降低废水中的铬含量最有利,请说明理由:()。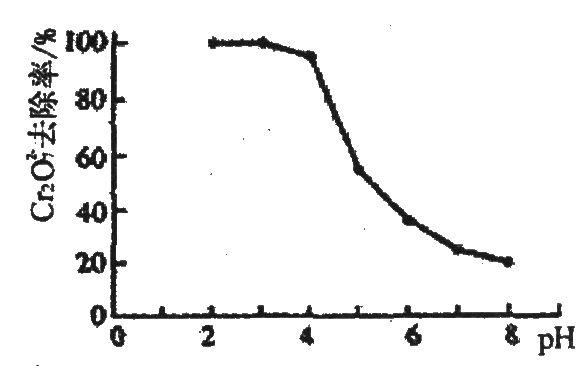
问题三、沉淀转化在生产中也有重要应用。例如,用Na2C03溶液可以将锅炉水垢中的CaS04转化为较疏松而易清除的CaC03,该沉淀转化到达平衡时,其平衡常数K=()。(已知Ksp(CaS04)=9.1x10-6,Ksp(CaC03)=2.8x10-9)
A.1∶1
B.5∶16
C.2∶3
D.3∶2
高铁酸钾是一种高效的多功能的水处理剂。工业上常采用NaClO氧化法生产,原理为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O Na2FeO4+2KOH=K2FeO4+2NaOH 主要的生产流程如下: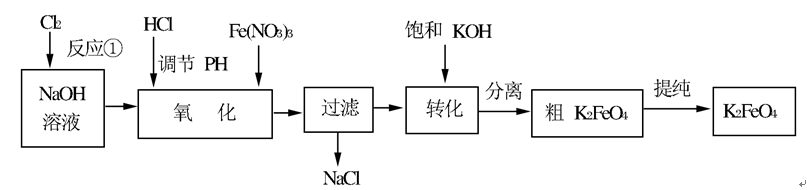 问题一、写出反应①的离子方程式()。
问题一、写出反应①的离子方程式()。
问题二、流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4)()Ksp(Na2FeO4)〔填“>”或“<”或“=”〕。
问题三、反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图1为不同的温度下,Fe(NO3)3不同质量浓度对生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最正确时,NaClO浓度对K2FeO4生成率的影响
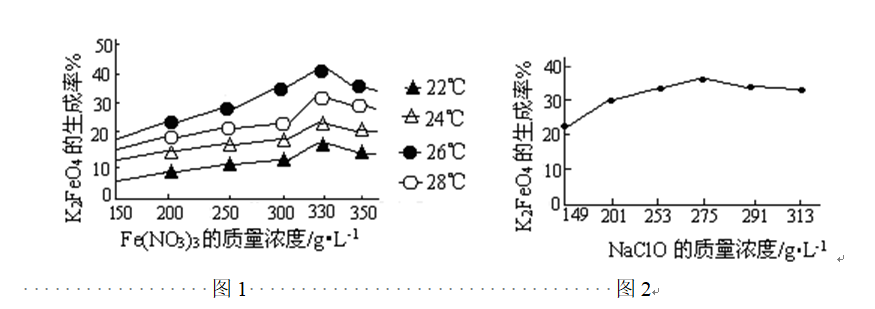
①工业生产中最正确温度为()℃,此时Fe(NO3)3与NaClO两种溶液最正确质量浓度之比为()。
②假设NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:()。假设Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化复原反应生成K3FeO4,此反应的离子方程式:()。
问题四、K2FeO4在水溶液中易水解:
4FeO42—+10H2O 4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液()(填序号)。
4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液()(填序号)。
AH2O
BCH3COONa、异丙醇
CNH4Cl、异丙醇
DFe(NO3)3、异丙醇
某氮肥厂氨氮废水中的氮元素多以NH和NH3·H2O的形式存在,该废水的处理流程如下:![]()
问题一、过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用:()。
②用化学平衡原理解释通空气的目的:()。
问题二、过程Ⅱ:在微生物作用的条件下,NH经过两步反应被氧化成NO。两步反应的能量变化示意图如下:
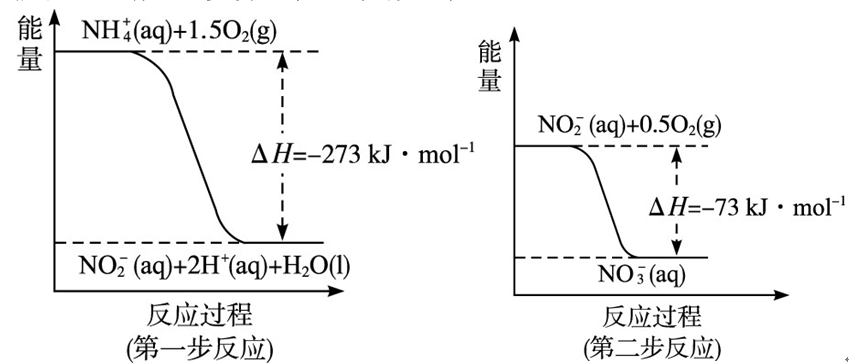
①第一步反应是()反应(选填“放热”或“吸热”),判断依据是()。
②1molNH(aq)全部氧化成NO(aq)的热化学方程式是()。
问题三、过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3复原成N2。假设该反应消耗32gCH3OH转移6mol电子,则参加反应的复原剂和氧化剂的物质的量之比是()。
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.2000mol/LNaOH标准溶液滴定HCl和CH3COOH的混合溶液(混合液中两种酸的浓度均为0.1mol/L),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,所得溶液Ag+浓度大小关系:①>④>②>③
A.适当增加NaOH浓度,NaOH浓度提高既可使其活度系数增大,又可提高溶液的沸点,因此不论在热力学或动力学方面都是有利的。但NaOH浓度增加,在一定液固比下NaOH用量增加。
B.将矿研磨,一般要求<=0.043mm的占90%左右。
C.提高温度,在常压设备中浸出时,一般在接近溶液的沸点温度下进行;在密闭高压设备中进行时,一般温度达150~170℃。
D.采取一定的矿物原料活化措施。