 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在一定条件下,在2L的密闭容器中充入2molSO2 和一定量的O2 ,发生反应2SO2(g)+O2(g) 2SO3(g),进行到4min时,测得n(SO2)=0.4mol,若反应进行到2min时,容器中n(SO2)为()
A.1.6mol
B.1.2mol
C.大于1.6mol
D.小于1.2mol
 答案
答案
D、小于1.2mol
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.1.6mol
B.1.2mol
C.大于1.6mol
D.小于1.2mol
 答案
答案
D、小于1.2mol
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“在一定条件下,在2L的密闭容器中充入2molSO2 和一定量…”相关的问题
更多“在一定条件下,在2L的密闭容器中充入2molSO2 和一定量…”相关的问题
A.密闭容器中充入1 mol N2和3 mol H2可生成2 mol NH3
B.一定条件下,可逆反应达到平衡状态,该反应就达到了这一条件下的最大限度
C.对于任何反应增大压强,化学反应速率均增大
D.化学平衡是一种动态平衡,条件改变,原平衡状态不会被破坏
A.SO2和SO3的物质的量一定相等
B.NO2和SO3的物质的量一定相等
C.反应混合物的总物质的量一定等于反应开始时NO2和SO2的总物质的量
D.SO2、NO2、NO、SO3的物质的量一定相等
过度排放CO2会造成”温室效应“,科学家正在研究如何将CO2转化为可以利用的资源,其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH)。其化学方程式为: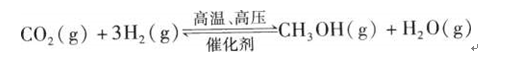
请填空:
问题一、写出上述反应的平衡常数表达式K=()。
问题二、在容积为2L的密闭容器中,用一定量二氧化碳与一定量氢气在一定条件下合成甲醇,实验结果如下图。以下说法正确的选项是()。
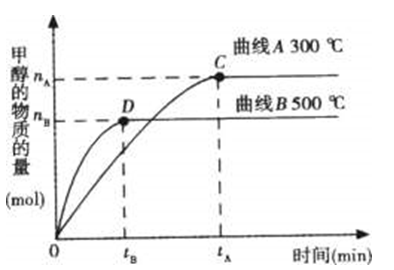
A在300℃,从反应开始到平衡,甲醇的平均反应速率
B反应体系从300℃升温到500℃,平衡常数K变大
C该反应的正反应为放热反应
D处于C点的反应体系从300℃升温到500℃n(H2)/n(CH3OH)增大
问题三、25℃、1.01×105Pa时16g液态甲醇完全燃烧,当恢复至原状态时,放出362.9kJ热量,此反应的热化学方程式为()。
问题四、选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极应加入或通入的物质是,正极的电极反应式为()。
A.当v(CO)(正)=v(H2)(正),时,反应达到平衡状态
B.其他条件不变,适当增加C(s)的质量会使平衡正向移动
C.保持容器体积不变,充入少量He使体系压强增大,反应速率一定增大
D.其他条件不变,仅将容器的体积缩小一半,再次达到平衡时,H20(g)的平衡浓度可能是原来的2.1倍
A.0.45 mol/L
B.0.6 mol/L
C.0.9 mol/L
D.1.2 mol/L
A.质量比为1∶9的H2和O2
B.质量比为3∶6的C和O2
C.质量比为1∶6的CH4和O2
D.质量比为7∶2的CO和O2
A.1.2mol/(L·min)
B.1.8mol/(L·min)
C.0.6mol/(L·min)
D.0.4mol/(L·min)
偶氮甲烷(CH3NNCH3)气体的分解反应
(CH3NNCH3)(g)→C2H6(g)+N2(g).
为一级反应.在287℃的真空密闭恒容容器中充入初始压力为21.332kPa的偶氮甲烷气体,反应进行1000s时测得系统的总压为22.732kPa,求速率常数k及半衰期t1/2.
氮化镓(GaN)是第三代半导体材料,具有热导率高、化学稳定性好等性质,在光电领域和高频微波器件应用等方面有广阔的前景。
(1)传统的氮化镓制各方法是采用GaC13与NH3在一定条件下反应。NH3的电子式为()。
(2)Johnson等人首次在1100℃下用液态镓与氨气制得氮化镓固体,该可逆反应每生成1molH2放出10.3kJ热量。其热化学方程式为()。
(3)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中NH3的体积分数与压强(p)、温度(T)的关系如图所示。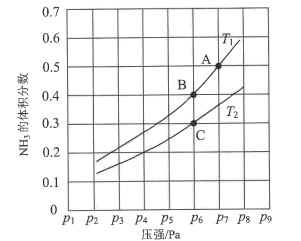 ①下列说法正确的是()(填标号)。
①下列说法正确的是()(填标号)。
a.温度:T1>T2
b.当百分含量ω(NH3)=ω(H2)时,说明该反应处于化学平衡状态
c.A点的反应速率小于C点的反应速率
d.温度恒定为T2,达平衡后再充入氦气(氦气不参与反应),NH3的转化率不变
②既能提高反应速率又能使平衡正向移动的措施有()(写出一条即可)。
③气体分压(p分)=气体总压(p总)×体积分数,用平衡分压代替物质的量浓度也可以表示平衡常数(记作Kp)。在T2时,用含p6的计算式表示C点的()。
(4)如图可表示氮化镓与铜组装成的人工光合系统的工作原理。H+向()(填“左”或“右”)池移动;铜电极上发生反应的电极反应式为()。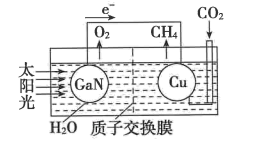
A.Z为0.3 mol•L-1
B.Y2为0.4 mol•L-1
C.X2为0.2 mol•L-1
D.Z为0.4 mol•L-1