 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[判断题]
由于φϴ(Cu2+/Cu)>0,所以电解CuCl2水溶液时,在阴极上得到的总是Cu而不是H2;同理,由于E(Zn2+/Zn
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“由于φϴ(Cu2+/Cu)>0,所以电解CuCl2水溶…”相关的问题
更多“由于φϴ(Cu2+/Cu)>0,所以电解CuCl2水溶…”相关的问题
计算原电池(一)Cu|Cu2+(1.0 mol·kg-1)||Ag+(1.0 mol·kg-1)|Ag()在下述情况下电动势改变值:(1)Cu2+浓度降到1.0X10-3mol·kg-1(2)加入足量的CI-使AgCl沉淀,设CI-浓度为1.561 mol·kg-1
A.Fe3+和Cu
B.Fe2+和Sn2+
C.Cu2+和Fe
D.Fe3+和Fe
(2007年)25℃,在[Cu(NH3)4]SO4水溶液中,滴加BaCl2时有白色沉淀产生,滴加NaOH时无变化,而滴加Na2S时则有黑色沉淀生成,以上实验现象说明该溶液中(KS为溶度积常数)()。
A.已无SO42-离子
B.已无游离的NH3
C.已无Cu2+离子
D.c(Ba2+).c(SO42-)≥Ks(BaSO4) c(Cu2+).c(OH-)2<Ks[Cu(OH)2和c(Cu2+).c(S2-)>Ks(CuS)
在0.050mol·L-1CuSO4溶液中通人H2S至饱和(0.10mol·L-1),溶液中残留的Cu2+浓度等于多少?(不考虑H++S-=HS-)[已知:Kspθ(CuS)=1.27X10-36;Ka1θ·Ka2θ(H2S)=1.0X10-19]
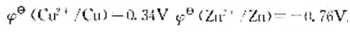 ,求此时原电池的电动势比标准状态时的电动势()
,求此时原电池的电动势比标准状态时的电动势()A.上升0.24V
B.下降0.24V
C.上升0.12V
D.下降0.12V