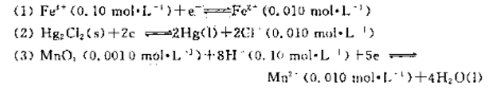更多“数据,计算下列反应在298K时的”相关的问题
更多“数据,计算下列反应在298K时的”相关的问题
计算合成氨反应N2(g)+3H2(g)=2NH3(g)在673K时的标准平衡常数,并指出在673K,下列三种情况下反应向何方向进行? (1)P(NH3)=304kPa,P(N2)=171 kPa,P(H2)=2 022kPa; (2)p(NH3)=600kPa,P(N2)=625kPa,P(H2)=1 875kPa; (3)p(NH3)=100kPa,P(N2)=725kPa,P(H2)=2 175kPa。 在没有平衡浓度或平衡分压时,标准平衡常数KΘ 可由标准吉布斯函数变[△rGΘm]求得:△rGΘm(T)=-RTlnKΘ ,而 △rGΘm(T)≈△rHΘm(298K)-T△rSΘm(298K),所以,可根据热力学数据表中反应物和生成物的标准摩尔生成焓△rHΘm(298K)和标准摩 尔熵SΘm(298K)计算反应的标准焓变△rHΘm(298K)和标准熵变 △rSΘm(298K),进而计算出标准平衡常数KΘ。 气体反应在一定反应物和生成物分压下的方向,可由反应商J与平衡常数KΘ相对大小进行判断。
根据下列在298K和标准压力下的热力学数据,计算HgO(s)在该温度时的解离压。
(1)电池Pt|H2(PH2) |NaOH(a) |HgO(s) |Hg(I)的标准电动势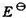 =0.9265V;
=0.9265V;
(2)反应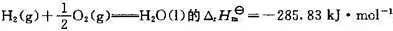 ;
;
(3)298K时,下表为各物质的标准摩尔熵值:

植物在光合作用中合成葡萄糖的反应可以近似表示为:
6CO2(g)+6H2O(1)=C6H12O6(s)+6O2(g)
计算反应的标准摩尔吉布斯自由能,判断反应在298K及标准状态下能否自发进行,已知葡萄糖的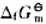 (C6H12O6·s) =-910.5kJ·mol-1。
(C6H12O6·s) =-910.5kJ·mol-1。
反应N2(g)+3H2(g)==2Nn3(g)在298K时的△rHmΘ=一92.88kJ/mol,求此反应在398K时的△rHmΘ。已知: Cp,m(N2,g)=(26.98+5.912×10-3T一3.376×10-7T2)J/(K.mol) Cp,m(H2,g)=(29.07-0.837×10-3T+20.12×10-7T2)J/(K.mol) Cp,m(NH3,g)=(25.89+33.00×10-3T一30.46×10-7T2)J/(K.mol)
乙醇气体脱水制乙烯,反应为: C2H5OH(g)→C2H4(g)+H2O(g) 试计算298K的△rS0,mΘ。 (2)若将反应写成: 2C2H5OH(g)→C2H4(g)+2H2O(g), 则298K的△rS又是多少?

计算下列等温反应(298K)的△rGmΘ: C6H6(g)+C2H2(g)→C6H5C2H3(g) 已知298K时C6H5C2H3的△fHmΘ=147.36J/(K.mol),SmΘ=345.1J/(K.mol)。
在600K、100kPa压力下,生石膏的脱水反应为
CaSO4·2H2O(s)===CaSO4(s)+2H2O(g)
试计算该反应进度为1mol时的Q、W、△Um、△Hm、△Sm、△Am及△Gm。已知各物质在298K、100kPa的热力学数据如下表所示:
物质 | frac{Delta_{f}H_{m}^{Theta }}{kJcdot mol^{-1}} | frac{S_{m}^{Theta }}{Jcdot mol^{-1}cdot K^{-1}} | frac{C_{p,m}}{Jcdot mol^{-1}cdot K^{-1}} |
CaSO4·2H2O(s) | -2021.12 | 193.97 | 186.20 |
CaSO4(s) | -1432.68 | 106.70 | 99.60 |
H2O(g) | -241.82 | 188.83 | 33.58 |

 数据,计算下列反应在298K时的
数据,计算下列反应在298K时的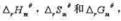
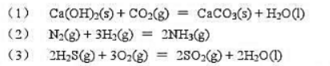

 如果结果不匹配,请
如果结果不匹配,请 
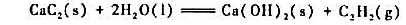
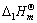 。
。