 更多“计算下列原电池的电动势,写出相应的电池反应.”相关的问题
更多“计算下列原电池的电动势,写出相应的电池反应.”相关的问题
第1题
将锌片插入1dm3,0.10mol·dm-3Zn2+溶液中构成电极A,将锌片插入1dm3,0.
010mol·dm-3Zn2+溶液中构成电极B。
点击查看答案
(1)试写出A和B组成的原电池的电池符号;
(2)试计算A和B组成的原电池的电动势;
(3)试求当A池中的c(Zn2+)消耗掉0.020mol·dm-3时,原电池的电动势。
第2题
有电对(1)试分别写出上面电对作为正极和负极时在电池符号中的表示方法。(2)选用上面的电对,任意
有电对(1)试分别写出上面电对作为正极和负极时在电池符号中的表示方法。(2)选用上面的电对,任意
点击查看答案
有电对

(1)试分别写出上面电对作为正极和负极时在电池符号中的表示方法。
(2)选用上面的电对,任意组成两种合理的原电池,分别用电池符号表示出来。利用本书附录中标准电极电势表的数据计算电池的电动势并写出其电动势的能斯特方程。
第3题
已知反应2Cr3++3Cl2+7H2O=Cr2O72-+6C1-+14H+(Cr2⌘
已知反应2Cr3++3Cl2+7H2O=Cr2O72-+6C1-+14H+(Cr2⌘
点击查看答案
已知反应
2Cr3++3Cl2+7H2O=Cr2O72-+6C1-+14H+
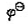 (Cr2O72-/Cr3+)=1.33V,
(Cr2O72-/Cr3+)=1.33V,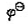 (Cl2/CI-)=1.36V,F=95500J·V-1·mol-2若在298K时组成原电池。
(Cl2/CI-)=1.36V,F=95500J·V-1·mol-2若在298K时组成原电池。
(1)写出该原电监的电池符号,并计算标准电动势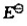 ;(2)计算
;(2)计算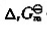 (298K)并判断反应进行的方向;(3)计算标准平衡常数
(298K)并判断反应进行的方向;(3)计算标准平衡常数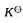 ;(4)若c(H+)=10mol·dm-3,其他离子浓度均为标准浓度,求原电池的电动势E并判断反应进行的方向
;(4)若c(H+)=10mol·dm-3,其他离子浓度均为标准浓度,求原电池的电动势E并判断反应进行的方向
第5题
用F电极和甘汞电极与溶液构成原电池,用离子计测得1.00×10-3mol·L-1NaF标液的电池
电动势为334mV.测得1.00×10-5mol·L-1NaF标液的电池电动势为278mV,测得某水样的电池电动势为300mV,计算该水样中F-的含量。
点击查看答案
第7题
甲烷燃烧过程可设计成燃料电池.当电解质为酸性溶液时,电极反应和电池反应分别为 已知,25°C时
甲烷燃烧过程可设计成燃料电池.当电解质为酸性溶液时,电极反应和电池反应分别为
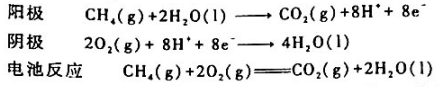
已知,25°C时有关物质的标准摩尔生成吉布斯函数 为
为
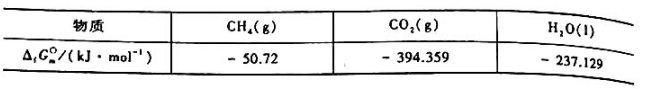
计算25°C时该电池的标准电动势.
第8题
[(Sn4+/Sn2+)=0.15V]标准状态下,Sn4+/Sn2+与氢电极组成原电池,电池反应为()
A.Sn2++2H+Sn4++H2
B.Sn4++H2Sn2++2H+
C.Sn4++2H+Sn2++H2
D.Sn2++H2Sn4++2H+
第10题
计算原电池(一)Cu|Cu2+(1.0 mol·kg-1)||Ag+(1.0 mol·kg-1)|Ag(+)
计算原电池(一)Cu|Cu2+(1.0 mol·kg-1)||Ag+(1.0 mol·kg-1)|Ag()
点击查看答案
计算原电池(一)Cu|Cu2+(1.0 mol·kg-1)||Ag+(1.0 mol·kg-1)|Ag()在下述情况下电动势改变值:(1)Cu2+浓度降到1.0X10-3mol·kg-1(2)加入足量的CI-使AgCl沉淀,设CI-浓度为1.561 mol·kg-1

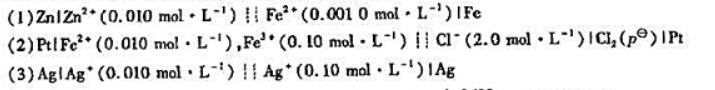

 如果结果不匹配,请
如果结果不匹配,请 
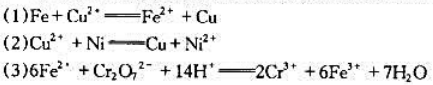
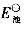 ,再求出电池反应的平衡常数。
,再求出电池反应的平衡常数。

















